研究内容
ヒトゲノムプロジェクトにおいて同定されたタンパク質コード(mRNA)遺伝子数は意外に少なく2万程度とされています。では、進化的に高度な生物種はどのように多様な細胞機能を獲得しているのでしょうか。選択的RNAスプライシングは一つの遺伝子から複数のRNAアイソフォームを産生するため、多様性を生み出すのに重要であることが知られています。また、最近のゲノムワイド RNA シークエンス技術により、ヒトゲノムの大部分を占める遺伝子間領域からもタンパク質をコードしていない転写産物(noncoding RNA, ncRNA)が数多く検出されています。スプライシング同様、ncRNAの発現調節も細胞機能の多様性に貢献している可能性が考えられています。特に、細胞ストレスで誘導されるncRNAやがんなど疾患条件下で検出される非コードRNAが多数報告されていますが、解析技術の限界もあり体系的に整理されていません。実際、機能が同定されているncRNAは僅かで、その遺伝子発現制御の根幹はよくわかっていません。
私たちは遺伝子発現制御機構を理解する目的で、以下のような独自の革新的ゲノム転写解析技術(1)1塩基解像度新生RNAマッピング mNET-seq法(Nojima et al., Cell 2015; Nojima et al., Nat Prot 2016)、(2)転写複合体解析 mNET-MS法( Nojima et al., Mol Cell 2018a)、(3)1ヌクレオソーム解像度ヒストン修飾マッピング mNuc-seq法( Nojima et al., Mol Cell 2018b)、(4)全長新生RNA解析 POINT法 (Sousa-Luis et al., Mol Cell 2021) を次々に開発してきました。これらの技術を駆使し、非コードゲノムを含む全ゲノム領域の作動原理解明を転写研究とRNAプロセシング研究の両面から取り組んでいます。具体的には中心テーマとして以下の研究を進めています。
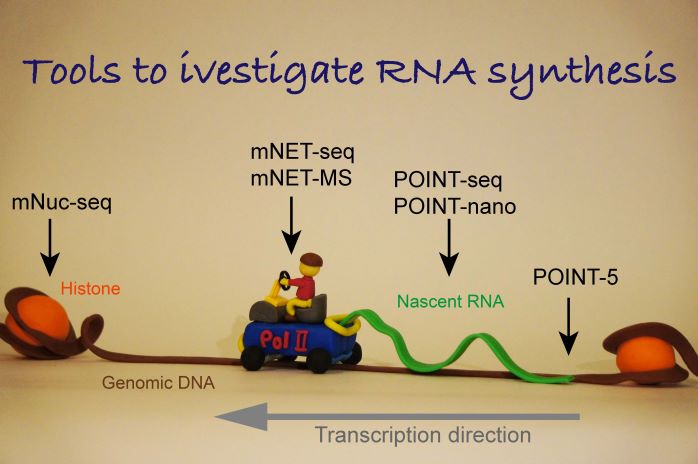
(1)mRNA遺伝子とncRNA遺伝子の転写終結機構
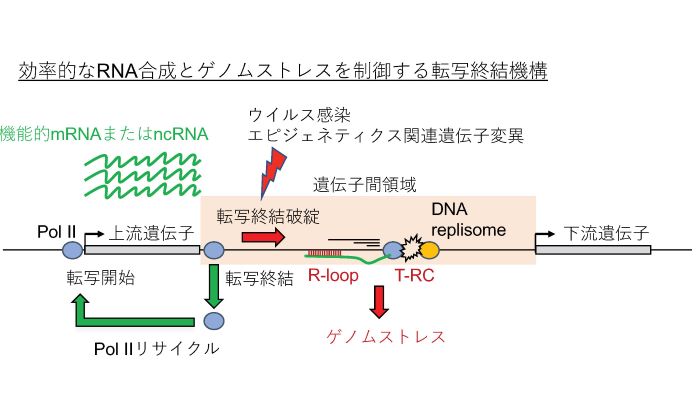
転写はどのように終わるのか、そんな疑問はありませんか?転写終結はあまり注目されてこなかった遺伝子発現ステップですが、意外に重要です。転写が正しく終わることは次の転写の再開始に重要ですし、転写終結破綻によって下流の遺伝子の転写にも大きな影響を及ぼします。また、最近では転写終結破綻が遺伝子間非ゲノム領域の転写を活性化し、転写装置とDNA複製装置の衝突(Transcription-Replication Conflict, T-RC)やDNA-RNAハイブリッド(R-loop)構造を介するゲノムストレスを誘導することがわかってきました(Nojima et al., Mol Cell 2018b)。
転写終結に最も重要な配列は遺伝子の3’末端に存在するポリAシグナル(AATAAA)と考えられています。さらに、ポリAシグナルに結合する Cleavage/Polyadenylation(CPA)因子も転写終結を制御します。その他にも制御因子が同定され、ウイルス感染やある種の細胞外刺激も転写終結破綻を引き起こしていることがわかってきましたが、その詳細な分子機構はまだよくわかっていません。特に enhancer RNA を含む long ncRNA(lncRNA)転写の終結はさらに謎が多く、mRNA転写終結とは異なります。私たちの研究室では、がんや神経疾患、ウイルス感染などの病気でのゲノム転写終結がどのように制御されているのか、その分子機構をmNET法やPOINT法などの独自の解析系を駆使して理解したいと考えています。その成果は、人工的なゲノムストレスのコントロールを可能とし、新しい病気の治療法の開発に繋がると信じています。
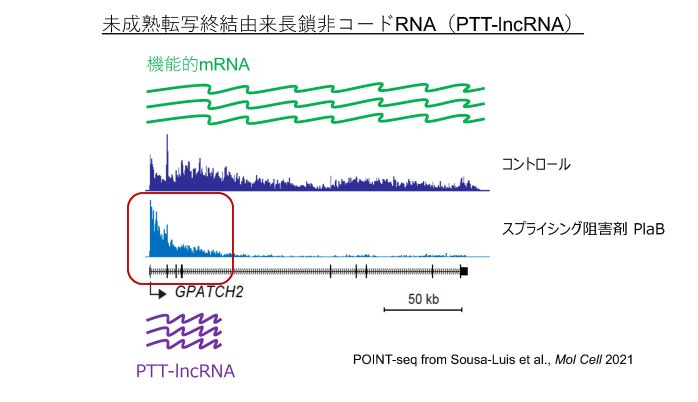
(2)“未成熟”転写終結制御機構とそれ由来lncRNAの生理学的機能
遺伝子3’末端まで転写伸長反応が行われず、イントロンなどの遺伝子内で転写が終結することがあります。この現象は未成熟転写終結(Premature Transcription Termination, PTT)と呼ばれています。現在まで、スプライシングに関わるUridine rich small ncRNAタンパク質複合体 (U snRNP)の中のU1やU2 snRNPがPTTを抑制していると考えられています。さらに、特定のヒストンやDNA構造も転写をブロックすることが知られています。我々のグループは、U2 snRNPを標的としたスプライシングを阻害剤で未成熟転写終結が引き起こされることを明らかにしました(Sousa-Luis et al., Mol Cell 2021)。しかしながら、スプライシング阻害剤によるPTTの分子機構はよくわかっていません。さらには、このPTT由来の転写産物はlncRNAと考えられますが(PTT-lncRNA)、そのlncRNA自体もしくはコードするペプチドの機能はわかっていません。スプライシング阻害剤が抗癌剤として働くため、PTT-lncRNAが抗癌機能を有している可能性があります。本研究室では、lncRNAを利用した抗癌治療の可能性を模索し、開発を試みたいと考えています。
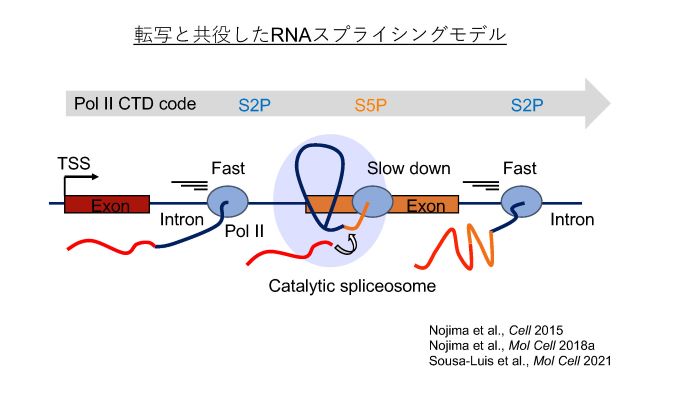
(3)RNA polymerase II (Pol II) 転写とpre-mRNA スプライシングの協調
スプライシングは Pol II 転写と共役して起こると言われています(一部例外あり)。私たちは Pol II転写装置がエクソン上で一時停止することを明らかにしています(Nojima et al., Cell 2015; Nojima et al., Mol Cell 2018a; Sousa-Luis Mol Cell 2021)。この一時停止はスプライシング反応を開始するために必要ではないかと考えられています。スプライシング完了後、Pol II 転写装置はは再び動き出し、次のエクソンまでスピードを上げると考えています(Sousa-Luis et al., Mol Cell 2021)。私たちの研究室では、Pol II 転写スピードのスプライシング制御を掘り下げて研究したいと思っています。
多くのがんではクロマチンの性質を変えるクロマチンリモデラーに変異が見つけられています。このような変異はPol II 転写スピードや転写装置の質を変化させると考えられるため、Pol II 転写と協調して起こるスプライシング反応にも影響があると仮説を立てています。特に、選択的スプライシング制御には Pol II 転写スピードは重要です。独自のゲノム解析技術により、がんクロマチン環境でのPol II 転写装置の一時停止、スプライシング中間体、スプライシングのキネティクスを解析します。最終的には、転写スピードを調節する化合物や外部刺激によって細胞増殖をコントロールすることを目標としています。
これら以外にも興味深いプロジェクトが沢山あります。英国滞在時には、ティータイムで仲間と一緒に雑談する中、新しいアイデアも生まれてくることが数多くありました。リラックスした環境でディスカッションを重ね、生物学的または医学的に重要な発見を世界に次々と発信する研究室を目指しています。